Descoberts nous mecanismes que provoquen ceguesa i obren la porta a nous tractaments
Un estudi liderat per la Dra. Gemma Marfany, investigadora de l'Institut de Recerca Sant Joan de Deu · Institut de Biomedicina de la Universitat de Barcelona, revela com la manca del gen CERKL, que causa malalties hereditàries de la visió, és capaç d'alterar la capacitat de la retina per combatre l'estrès oxidatiu i causar ceguesa.
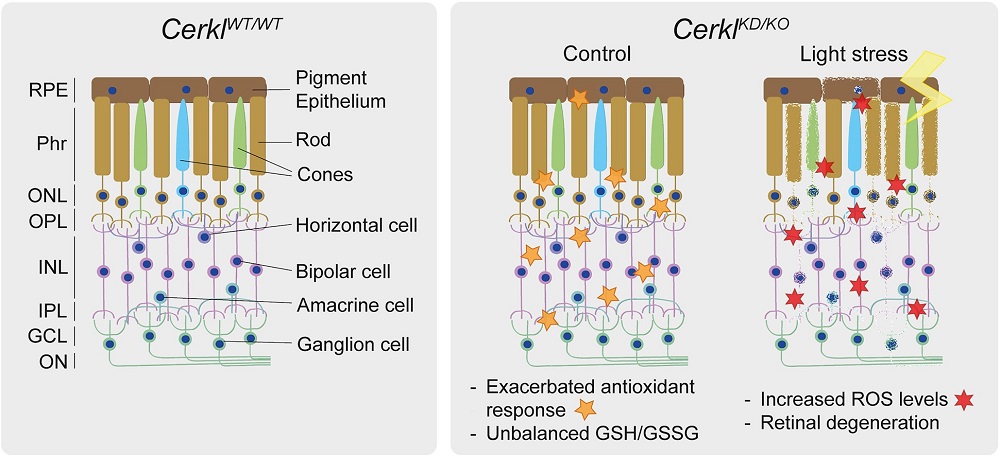
Encara hi ha moltes incògnites per resoldre sobre el mecanisme d'acció del gen CERKL, causant de la retinosi pigmentària i altres malalties hereditàries de la visió. Ara, un equip liderat per la Dra. Gemma Marfany ha descrit com la manca del gen CERKL altera la capacitat de les cèl·lules de la retina per combatre l'estrès oxidatiu generat per la llum i desencadena mecanismes de mort cel·lular que causen ceguesa.
El nou treball, publicat a la revista Redox Biology, és un pas endavant per caracteritzar la ceguesa hereditària i identificar mecanismes clau per abordar futurs tractaments basats en la medicina de precisió. I revela per primer cop que quan falta el gen CERKL, les cèl·lules de la retina estan permanentment estressades.
"Aquest estat exacerbat basal fa que quan es causa un dany oxidatiu addicional -com amb l'estímul continu de la llum- les cèl·lules ja no siguin capaces de respondre perquè no poden activar més mecanismes de resposta antioxidant", detalla Gemma Marfany, coordinadora del grup de recerca Genètica Molecular Humana II de l'IRSJD i membre del Departament de Genètica, Microbiologia i Estadística de la Universitat de Barcelona. "Per tant, la retina està inflamada de manera permanent. Com a conseqüència, les cèl·lules retinals activen mecanismes de mort cel·lular, com la necroptosi i la ferroptosi. Tot i que els experiments s'han realitzat en ratolí, aquestes alteracions permeten explicar com i per què les cèl·lules fotoreceptores moren als pacients i causen la ceguesa".
Com respon la retina a la llum quan manca el gen CERKL?
La retina és un teixit neuronal que està sotmesa constantment a un estrès lumínic -per tant, oxidatiu- i les cèl·lules retinals han d'activar mecanismes antioxidants per fer-hi front. El nou treball es basa en un model de ratolí transgènic a què se li ha eliminat el gen CERKL mitjançant tècniques d'edició gènica (CRISPR). Aplicant tècniques electrofisiològiques, es va comprovar com la retina d'aquests ratolins sense CERKL degenera progressivament de manera semblant als pacients humans. Ara bé, com s'altera l'activitat fisiològica dels fotoreceptors quan el CERKL està mutat?
"Gràcies a la col·laboració multidisciplinària entre equips, hem pogut combinar diferents aproximacions per aprofundir en la patologia causada per mutacions a CERKL. Les tècniques de transcriptòmica han revelat com respon la retina a l'estrès lumínic quan no té la proteïna CERKL. Amb les anàlisis metabolòmiques s'han identificat les vies bioquímiques cel·lulars alterades que no permeten a la retina fer front al dany oxidatiu generat per l'excés de llum i acaben provocant la mort dels fotoreceptors", indica Gemma Marfany. "Considerem que CERKL és un gen de resiliència a l'estrès oxidatiu. Tot aquest coneixement complementa els estudis genètics i obre noves vies a futures aproximacions terapèutiques".
Descobrir la funció dels gens per poder dissenyar teràpies
Una de cada 3000 persones al món té algun tipus de distròfia hereditària de retina, una de les malalties rares de més incidència en la població. Fins ara, s'han identificat un total de 90 gens associats amb la retinosi pigmentària, però hi ha més de 300 gens que poden afectar la visió.
"És decisiu poder fer un bon diagnòstic genètic dels pacients i identificar el gen que causa la malaltia. Ara sabem que prop d'un 3% dels pacients amb retinosi pigmentària a Espanya porten mutacions al gen CERKL", apunta Marfany. "Bona part dels esforços malalties rares de la visió se centra precisament en aquest diagnòstic genètic dels pacients, però per comprendre l'efecte fisiològic d'aquestes mutacions cal analitzar què passa a les cèl·lules de la retina".
Identificar el gen causant de la malaltia i la funció fisiològica són els pilars per dissenyar una teràpia de precisió o personalitzada. En el cas de la teràpia gènica, sol ser costosa -en temps i diners- i només és accessible a un nombre limitat de pacients. «Ara bé, si coneixem millor quines són les vies alterades quan no existeix el gen CERKL, podrem pensar com compensar aquestes vies: per exemple, amb medicaments que puguin actuar sobre aquestes vies metabòliques i restaurar el funcionament correcte de les neurones de la retina i tornar a un estat més homeostàtic. Aquest tipus d'aproximació terapèutica és molt més assequible, i si alenteix el progrés de la malaltia, en podria beneficiar molts pacients».
El treball ha estat liderat per la Dra. Gemma Marfany, investigadora de l'Institut de Recerca Sant Joan de Déu i catedràtica de la Facultat de Biologia, l'Institut de Biomedicina de la Universitat de Barcelona (IBUB) i el Centre de Recerca Biomèdica a la Xarxa de Malalties Rares (CIBERER). També han participat en la investigació personal de la Universitat de València, el Centre de Biologia Molecular Severo Ochoa (CSIC-UAM) i l'Institut de Recerca Hospital 12 d'octubre de Madrid.
Notícia de referència
Es descobreixen nous mecanismes que causen ceguesa i que obren la porta a tractaments nous. Universitat de Barcelona.
Material audiovisual cedit per la Universitat de Barcelona.

"En el futur, volem generar nous models de la malaltia amb organoides de retina humana, i dissenyar estratègies de teràpia de precisió -teràpia gènica i també amb medicaments- basada en molècules que permetin revertir els símptomes més greus de la malaltia"