L'edició genètica per CRISPR/Cas9 obre les portes a una nova estratègia terapèutica per a les distròfies musculars congènites per dèficit de col·lagen VI
Un estudi, publicat a la revista International Journal of Molecular Sciences, descriu l'inici d'una nova estratègia terapèutica per a pacients amb distròfies musculars congènites per dèficit de col·lagen VI mitjançant el silenciament específic de les mutacions dominants usant l'edició genètica per CRISPR/Cas9 sobre el gen COL6A1 per millorar la xarxa de fibres de col·lagen VI en fibroblasts.
L'estudi liderat pels Drs. Cecilia Jimenez-Mallabrera i Arístides López-Márquez, de l'Institut de Recerca Sant Joan de Déu (IRSJD), compta amb la participació de l'Instituto Ramón y Cajal de Investigación Sanitaria, l'Institut de Biomedicina de la Universitat de Barcelona i el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER).
Les mutacions als gens COL6A1, responsables del mal assemblatge del col·lagen VI
Els trastorns relacionats amb el col·lagen VI són les segones distròfies musculars congènites més comunes i per a les quals encara no hi ha cap tractament. La seva gravetat varia des d'una miopatia de Bethlem relativament lleu fins a les distròfies musculars d'Ullrich molt més greus. Els pacients presenten alguna mutació en algun dels gens que codifiquen per a les tres cadenes de col·lagen VI, els gens COL6A1, COL6A2 i COL6A3. Aquests pacients, majoritàriament nens, mostren debilitat muscular progressiva, hiperlaxitud de les articulacions distals, contractures de les articulacions proximals i insuficiència respiratòria progressiva; disminuint la seva qualitat i esperança de vida.
Les principals mutacions en els gens de la cadena de col·lagen VI es troben en els segments essencials per al correcte acoblament de la triple hèlix del col·lagen VI i el desenvolupament de la seva funció a la matriu extracel·lular del múscul esquelètic i altres teixits.
La tècnica d'edició genètica de CRISPR/Cas9, nou abordatge terapèutic
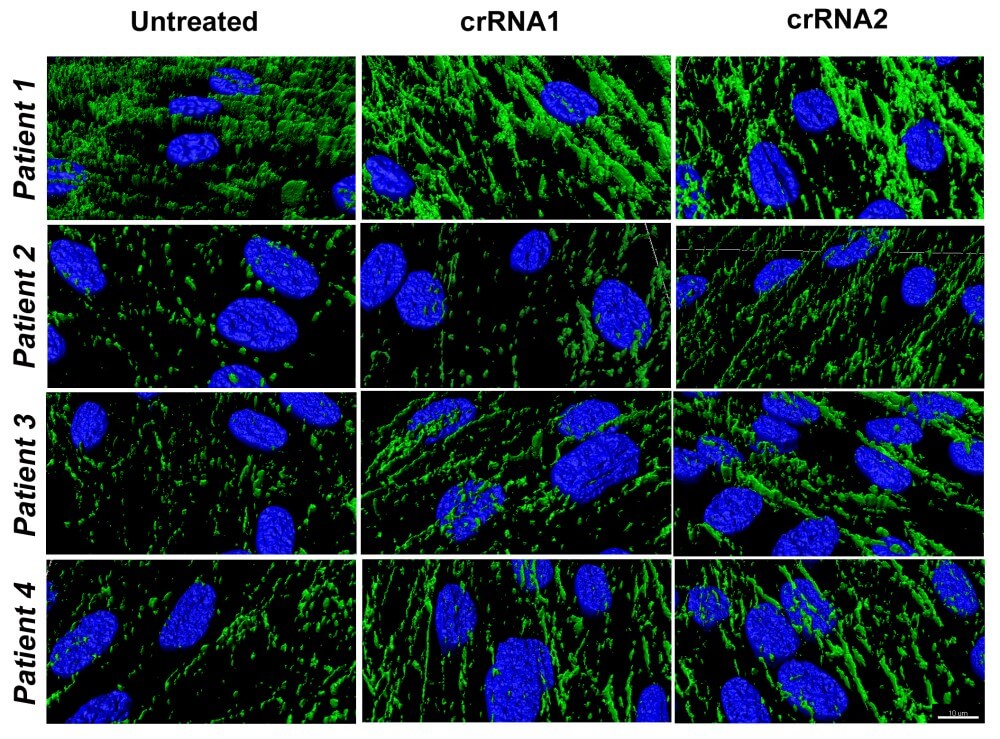
En el marc del treball publicat, l'equip investigador ha descrit els resultats de l'edició genètica mitjançant la tècnica de CRISPR/Cas9 en fibroblasts de la pell de quatre pacients amb la mateixa mutació dominant al gen COL6A1. La proteïna alterada generada per la còpia mutada del gen exerceix un efecte dominant negatiu sobre les còpies de col·lagen VI normals sent aquest el mecanisme causant de la malaltia.
"Vam realitzar dues aproximacions en paral·lel mitjançant la tècnica d'edició genètica CRISPR/Cas9 amb l'objectiu d'augmentar la prevalença de l'al·lel COL6A1 no mutat - al·lel salvatge - en fibroblasts de pacients amb la mutació dominant identificada en aquest gen. Aquests pacients presentaven un canvi en l'ADN que provocava que la proteïna presentés un aminoàcid diferent (Arginina en lloc de Glicina) i això afectava l'estructuració del col·lagen VI. Per una banda, intentarem corregir la mutació en l’al·lel mutat per poder obtenir la proteïna original d’ambdós al·lels, i, per altra banda, intentarem silenciar l'al·lel mutat perquè no es generés la proteïna mutada i així no competís amb la proteïna no mutada", comenta el Dr. Arístides López-Márquez, primer autor de l'article i investigador del grup "Investigació aplicada en malalties neuromusculars" de l'IRSJD, que en forma part CIBERER.
Els resultats han mostrat una alta especificitat per al silenciament de l'al·lel mutat i la preservació de l'expressió de l'al·lel no mutat. Això va ser comprovat mitjançant l'eina bioinformàtica Mosaic Finder d'anàlisi de NGS desenvolupada pels investigadors Miguel Ángel Moreno-Pelayo, Matías Morín i Sergio Fernández-Peñalver de l'Instituto Ramón y Cajal de Investigación Sanitaria i el CIBERER.
"Hem comprovat amb la nostra eina Mosaic Finder que l'eficàcia del silenciament per disrupció específica de l'al·lel mutat és 40 vegades més gran que la correcció de l'al·lel a la seva versió no mutada", comenta el Dr. Miguel Angel Moreno-Pelayo.
Així, els fibroblasts tractats amb la tècnica d'edició genètica presentaven una proporció més gran de col·lagen VI no mutat i, per tant, es va mantenir el correcte acoblament del col·lagen. Morfològicament, es va observar que les cèl·lules editades formaven una matriu extracel·lular amb un patró de microfibres de col·lagen VI més semblant a les cèl·lules sanes.
"Aquesta tècnica d'edició genètica mitjançant el silenciament de l'al·lel mutat és un nou pas cap a la teràpia de les distròfies musculars congènites per dèficit de col·lagen VI. Davant d'aquests resultats ara volem analitzar si el col·lagen VI presenta les seves funcions normals i si els resultats en fibroblasts també es donen en models animals, així seguirem avançant en la recerca d'una teràpia per a aquesta malaltia i poder arribar als pacients." Conclou la Dra. Cecilia Jiménez.
En l’estudi també han participat els Drs. Daniel Grinberg i Susana Balcells, membres de l’Institut de Biomedicina de la Universitat de Barcelona i investigadors de l’IRSJD.
Aquest treball és fruit de cinc anys de recerca liderats per l'equip de la Dra. Cecilia Jiménez Mallebrera (IRSJD i CIBERER) que va decidir emprendre una nova línia de recerca centrada en les teràpies personalitzades per a les distròfies musculars congènites, dins del seu grup de recerca "Investigació aplicada a malalties neuromusculars" de l'Institut de Recerca Sant Joan de Déu.
La investigació ha estat desenvolupada gràcies al finançament de l'Institut de Salut Carles III, CIBERER, la xarxa RAREGENOMICS i la Fundació Noelia.
Equip coordinador de l’estudi

Article de referència
López-Márquez A, Morín M, Fernández-Peñalver S, Badosa C, Hernández-Delgado A, Natera-de Benito D, Ortez C, Nascimento A, Grinberg D, Balcells S, Roldán M, Moreno-Pelayo MÁ, Jiménez-Mallebrera C. CRISPR/Cas9-Mediated Allele-Specific Disruption of a Dominant COL6A1 Pathogenic Variant Improves Collagen VI Network in Patient Fibroblasts. International Journal of Molecular Sciences. 2022; 23(8):4410. https://doi.org/10.3390/ijms23084410

Els resultats han mostrat una alta especificitat per al silenciament de l'al·lel mutat i la preservació de l'expressió de l'al·lel no mutat.
