El déficit de GDAP1 causa defectos del transporte mitocondrial y del calcio a los axones de la neuropatía de Charcot-Marie-Tooth
La ausencia de la proteína GDAP1 altera el transporte axonal de las mitocondrias y su tráfico anterógrado y retrógrado a lo largo de los nervios periféricos, este es uno de los resultados a lo que ha llegado un equipo liderado por el Institut de Recerca Sant Joan de Déu y publicado en Neurobiology of Disease.
Un equipo liderado por el Institut de Recerca Sant Joan de Déu demuestra que la ausencia de la proteína GDAP1 compromete la morfología y la función de las mitocondrias, además de alterar la homeostasis del calcio en las células neuronales. Estos resultados ayudan a entender los mecanismos celulares asociados a la degeneración axonal de las neuropatías de Charcot-Marie-Tooth.
GDAP1 es una proteína ubicada en la membrana externa de la mitocondria y que está implicada en los contactos de la membrana mitocondrial con el retículo endoplasmático y los lisosomas. Esta proteína juega un papel clave en la fisiología de los nervios periféricos y sus mutaciones están relacionadas con la enfermedad de Charcot-Marie-Tooth.
La enfermedad de Charcot-Marie-Tooth es un trastorno neurodegenerativo del sistema nervioso periférico, caracterizado por la debilidad y la atrofia de los músculos de las extremidades. Actualmente incluye dentro del grupo de neuropatías genéticas raras que afectan aproximadamente 1 de cada 2.500 personas.
El equipo de investigación dirigido por el Dr. Francisc Palau, director del IRSJD y del Instituto de Enfermedades Raras Pediátricas (ypor) del Hospital Sant Joan de Déu Barcelona, hace más de 20 años que trabaja en el estudio de las neuropatías genéticas.
Esta última publicación nace de un trabajo de más de 5 años, durante el cual el equipo investigador generó ratones knockout -técnica de ingeniería genética en la que se inactiva un gen concreto- por el gen GDAP1 con el objetivo de estudiar su función en las neuronas motoras y sensitivas.
"En cultivos celulares de motoneuronas embrionarias de ratones knockout para GDAP1 hemos observado alteraciones en la homeostasis del calcio y en el tráfico mitocondrial probando que haya una disfunción presináptica. Esta situación puede ser una de las muchas causas asociadas a la degeneración axonal muy importante en las neuropatías." Comenta la investigadora Azahara Civera-Tregón, primera autora del artículo.
Las mitocondrias que tienen alteraciones en GDAP1 muestran una reducción en su movimiento y cambios en el tráfico, esto provoca que el movimiento entre la terminal sináptica y el soma (cuerpo) de las neuronas no sea el adecuado.
Por un lado estos orgánulos presentaban una morfología alterada, eran más alargados y también se formaban esferas mitocondriales. Y por otro lado, presentaban defectos en la estructura de las crestas mitocondriales. Estas dos alteraciones están directamente relacionadas con el potencial de membrana mitocondrial, la respiración mitocondrial y la síntesis de ATP.
Los niveles de calcio neuronales, clave en la degeneración axonal
"Nuestros cultivos celulares mostraban altos niveles de calcio en el interior de las neuronas. Estos niveles podrían contribuir a la acumulación de mitocondrias alteradas dentro de las neuronas, que podría explicar las alteraciones en la función sináptica y por tanto su afecto en integridad axonal de estas neuronas." Destaca el Dr. Francisc Palau.
Las motoneuronas embrionarias son células muy sensibles a los cambios en la concentración plasmática de calcio. Cuando hay una elevación de esta concentración se produce una toxicidad celular que puede acabar con su degradación. El calcio también es un elemento clave para la producción de ATP y por lo tanto por la actividad sináptica de las neuronas.
En las células knockout para GDAP1, las alteraciones en la fisiología mitocondrial provoca que el efecto tampón de calcio de estos no sea el adecuado y como consecuencia las concentraciones de calcio aumentan significativamente.
"A través de este estudio hemos podido comprender como GDAP1 interviene en el mantenimiento de la función mitocondrial y la fisiología neuronal y axonal. Pero además, hemos visto que también está implicado en el movimiento de las mitocondrias a través del axón, la bioenergética de la célula y las concentraciones de calcio." Concluye el equipo investigador.
El trabajo publicado en la revista Neurobiology of Disease suma nuevas evidencias sobre el papel clave que podría tener la proteína GDAP1 en el mantenimiento de las funciones mitocondriales y su implicación en la fisiología neuronal y axonal. Este es un nuevo paso hacia la búsqueda de objetivos farmacológicos en el manejo clínico de las neuropatías.
El estudio, liderado por el Dr. Francisc Palau, ha contado con la participación de investigadores e investigadores del Institut de Recerca Sant Joan de Déu, el CIBER en Enfermedades Raras, el Centro de Biología Molecular Severo Ochoa y el Centro de Investigación en Bioingeniería de la Universidad Politécnica de Barcelona.
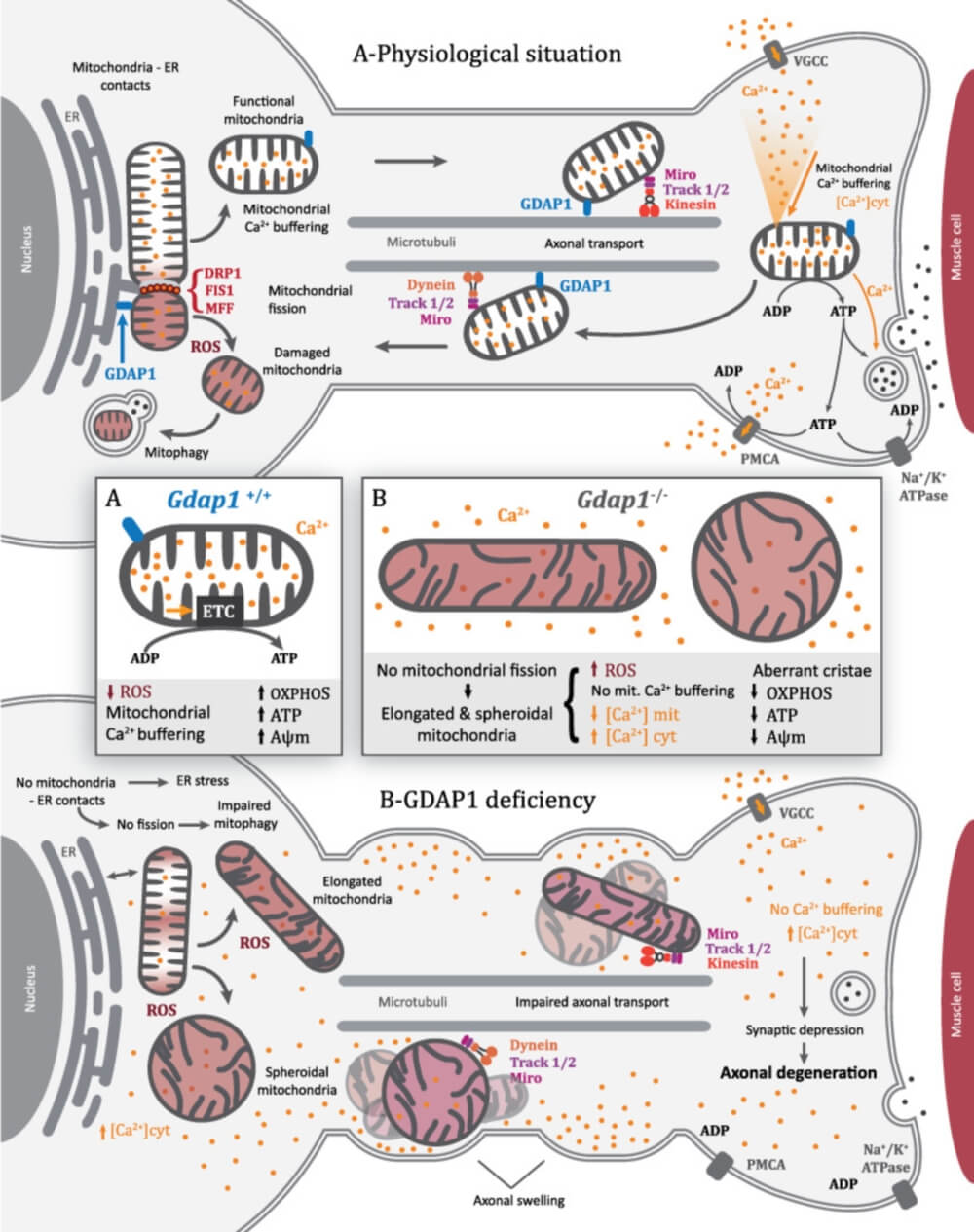
En esta imagen se puede observar el funcionamiento de una motoneurona sana vs el funcionamiento de una motoneurona knockout para GDAP1.
Artículo de referencia
Civera-Tregón A, Domínguez L, Martínez-Valero P, Serrano C, Vallmitjana A, Benítez R, Hoenicka J, Satrústegui J, Palau F. Mitochondria and calcium defects correlate with axonal dysfunction in GDAP1-related Charcot-Marie-Tooth mouse model. Neurobiol Dis. 2021 Feb 11;152:105300. doi: 10.1016/j.nbd.2021.105300. Epub ahead of print. PMID: 33582224.

